Reacciones de combustión (completa e incompleta) como procesos exotérmicos.
Combustión: la combustión ocurre cuando se cuenta con carbono (C) e hidrogeno (H), es lo que vendría siendo un hidrocarburo un ejemplo de hidrocarburo sencillo es el metano (CH4) entonces podemos decir que una reacción de combustión se da cuando ocurre una oxidación rápida donde el combustible reacciona con el comburente (este generalmente suele ser oxigeno) y al reaccionar liberan energía y dan como resultado dióxido de carbono (CO2) y vapor de agua (H2O).
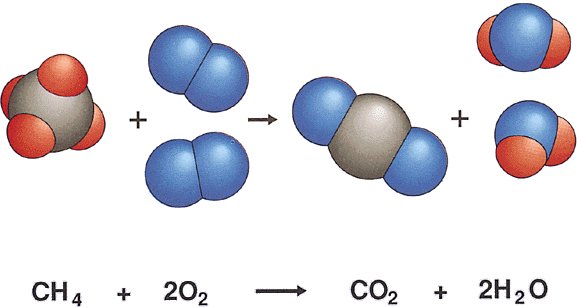
En la imagen podemos ver como el metano y el oxígeno al quemar el combustible fósil dan como resultado dióxido de carbono y vapor de agua.
¿Cómo balancear una reacción de combustión?
La forma más rápida seria: primero balancear los átomos de carbono
Después balancear los átomos de hidrógeno
Y por último balancear los átomos de oxigeno
Por ejemplo si tenemos CH4 + O2 = CO2 + H2O al balancearla siguiendo los pasos anteriores quedaría CH4 + 2O2 = CO2 + 2H2O
*Existen reacciones de combustión completas e incompletas pero ambas dependen de condiciones que necesitan:
Un elemento combustible (sustancia que en presencia de un comburente reacciona para iniciar una reacción de oxidación rápida en la cual libera energía)
Un comburente (sustancia que al reaccionar con un combustible nos da una oxidación rápida)
Calor (es necesario para que el combustible desprenda vapor en presencia del oxígeno hasta alcanzar la temperatura de ignición)
Fuente de ignición (la fuente, objeto o medio que nos brinda el calor para la mezcla inflamable)
Una reacción de combustión completa se da cuando se tiene el oxígeno necesario para que el combustible se queme y por tanto de como resultado vapor de agua más dióxido de carbono.
Por ejemplo al utilizar un soplete para soldar el acetileno (C2H2) está presente con el oxígeno del aire y tenemos que reacciona de la siguiente manera:
2C2H2(g) + 5O2(g) → 4CO2(g)+ 2H2O(g)
2C2H2(g) + 3O2(g) → 4CO(g) + 2H2O(g)
Una reacción de combustión incompleta, ocurre cuando no hay la cantidad suficiente de oxígeno para que el combustible se queme completamente, ejemplo:



No hay comentarios.:
Publicar un comentario